Os resultados enfatizam a posição da Agência como uma autoridade sanitária de referência internacional, reconhecendo seu corpo técnico capacitado e a manutenção de padrões regulatórios harmonizados com normas globais.
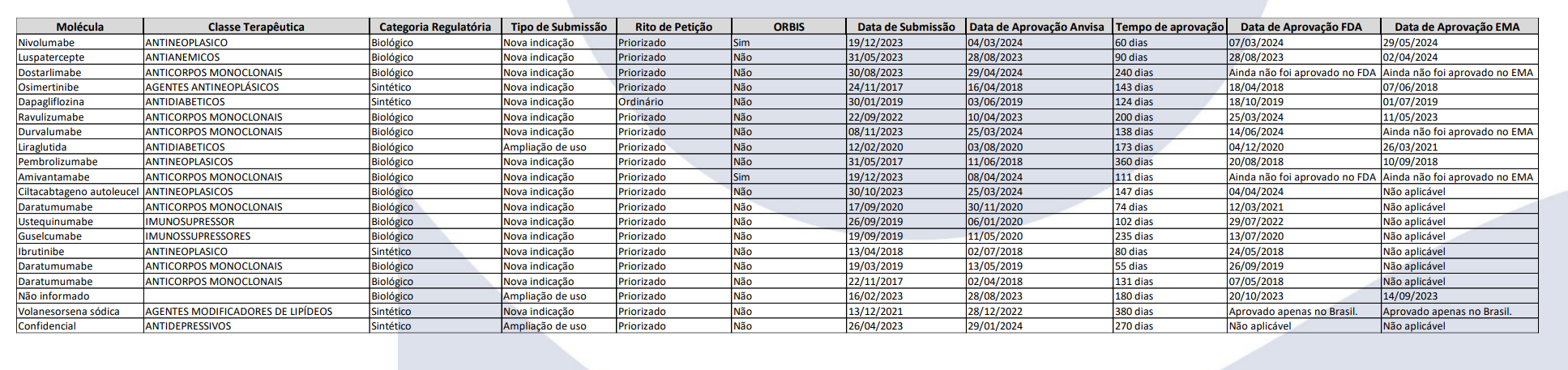
Foi divulgada nesta semana uma pesquisa sobre aprovações regulatórias concedidas pela Anvisa, em comparação com a Food and Drug Administration (FDA) e a European Medicines Agency (EMA), agências dos Estados Unidos da América e da União Europeia, respectivamente. Promovida pela Associação da Indústria Farmacêutica de Pesquisa (Interfarma), a pesquisa buscou demonstrar o desempenho da agência reguladora brasileira em comparação com outras autoridades internacionais.
Durante o período de 25 de junho a 17 de julho de 2024, a pesquisa realizada com 38 empresas associadas à Interfarma revelou que a Anvisa concedeu 20 aprovações regulatórias pós-registro de segurança e eficácia mais rapidamente que as agências internacionais. Essas aprovações abrangem a inclusão de novas indicações e ampliações de uso dentro do Projeto Orbis, sendo 25% destas para medicamentos sintéticos e 75% para medicamentos biológicos.
O Projeto Orbis, vinculado à agência norte-americana FDA, tem como objetivo auxiliar os pacientes a terem acesso mais rápido a tratamentos com potenciais benefícios em relação às terapias existentes.
Referência internacional
Os resultados da pesquisa enfatizam a posição da Anvisa como uma autoridade sanitária de referência internacional, reconhecendo seu corpo técnico capacitado e a manutenção de padrões regulatórios harmonizados com normas globais.
A pesquisa ressaltou ainda que, apesar do reconhecimento internacional, a exigência do Certificado de Produto Farmacêutico (CPP) do país de origem para registro de medicamentos no Brasil, requisito presente na Lei 6.360/1976, pode retardar o acesso a novas terapias, no caso de novos produtos.
A indústria farmacêutica também reconheceu os esforços da Anvisa, ainda que em situação bastante complexa em relação ao número de servidores – atualmente no menor contingente da sua história –, para antecipar aprovações regulatórias, em comparação com autoridades como a EMA e a FDA, mesmo diante desses desafios.
Esses resultados representam um impulso significativo para o Brasil como um destino atraente para investimentos em pesquisa e desenvolvimento farmacêutico.
Seguem abaixo os dados levantados pela Interfarma: