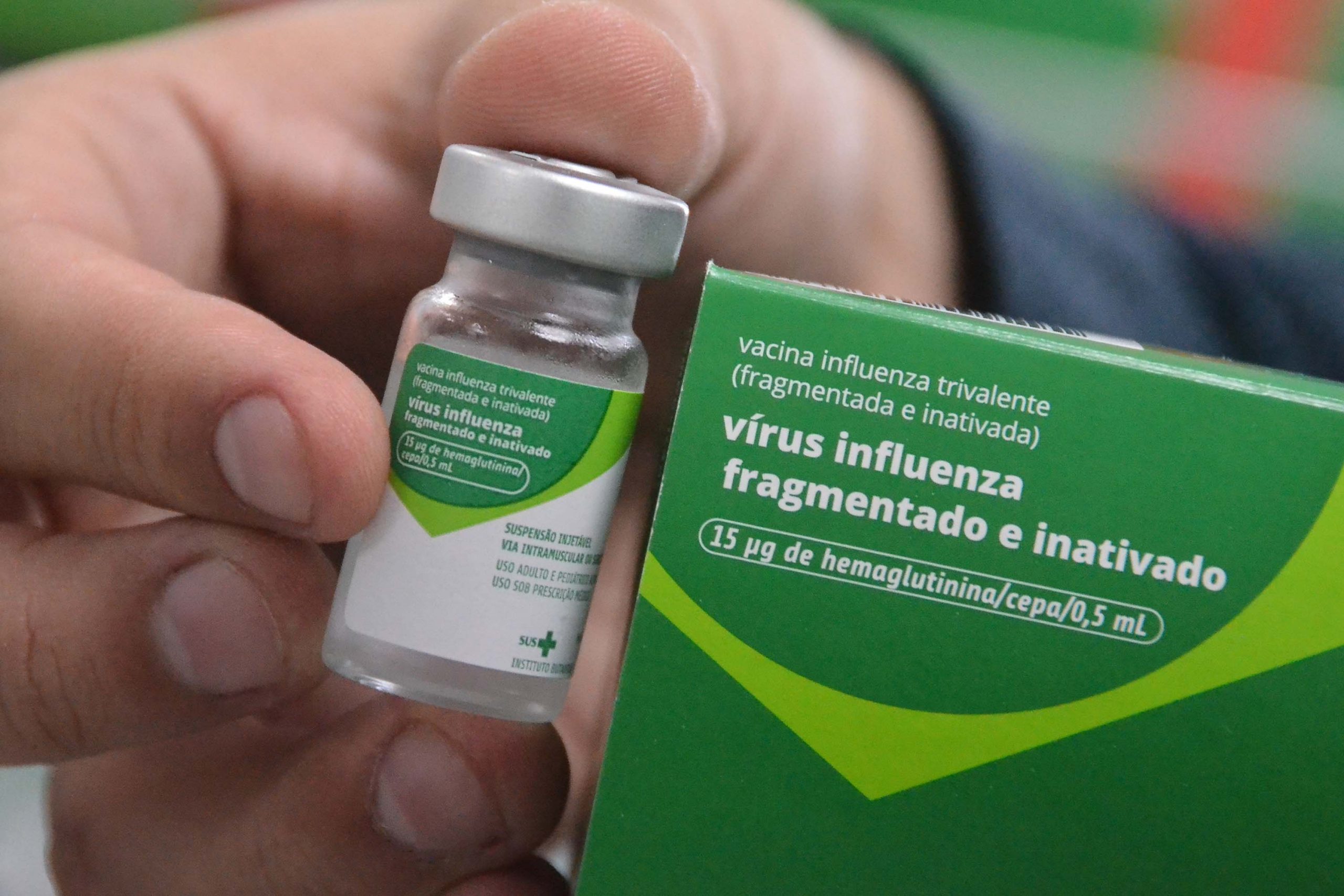
A vacina pré-pandêmica não será comercializada. Ela serve como base para a vacina pandêmica após a atualização da cepa que estiver causando a emergência.
Anvisa aprovou, nesta quarta-feira (6/3), a Resolução da Diretoria Colegiada (RDC) que dispõe sobre o registro de vacinas pré-pandêmicas contra influenza, atualização para uma cepa pandêmica, autorização de uso, comercialização e monitoramento das vacinas pandêmicas contra influenza.
A norma prevê diretrizes para o desenvolvimento e o registro de vacinas pré-pandêmicas de cepas influenza zoonóticas. Em outras palavras, cepas do vírus influenza que circulam em animais e ainda não possuem transmissão sustentada entre humanos, como a H5N1 ou H7N9, porém têm potencial para causar uma possível emergência em saúde pública.

A proposta passou por consulta pública (CP 1.180/2023) e está alinhada às melhores práticas regulatórias internacionais, já incorporadas por agências de referência. É importante ressaltar que a vacina pré-pandêmica contra a influenza não poderá ser comercializada, sendo apenas utilizada como base para a vacina contra a influenza pandêmica, após a atualização da cepa que estiver causando a emergência.
A norma, portanto, prevê o registro da plataforma vacinal, chamada de vacina pré-pandêmica, que não precisa ter uma composição ativa exata registrada, diferentemente de uma vacina comum. No futuro, a depender da necessidade, é possível atualizar a cepa e converter a vacina pré-pandêmica em pandêmica.
Leia também: Anvisa autoriza pesquisa com vacina tetravalente para influenza
A existência de uma matriz já avaliada e registrada pela Anvisa permite que, diante de um novo subtipo da influenza, o desenvolvimento de uma vacina específica contra esse subtipo seja feito de forma mais ágil, reduzindo o tempo para a chegada de um novo imunizante no mercado. Estamos falando de uma proposta de antecipação a uma possível emergência, mantendo o objetivo de promover e proteger a saúde.
Confira o voto do Diretor Relator, Antonio Barra Torres, e o voto da Diretora Meiruze Freitas.